徐州市第一人民医院召开伦理委员会会议

近日,市一院召开伦理委员会会议,对2020年医院立项拟开展的市科技创新资金资助课题和眼科王小娟博士带教的研究生毕业课题进行伦理审查。市一院伦委会委员、院外社区人士、律师、项目负责人、硕士研究生、硕士研究生导师等参加会议。伦委会主委赵玉良主持会议。

伦理办李泳同志首先汇报了中国矿业大学博士研究生轩吴凡的博士课题《尘肺群体呼气筛查及早期预警技术研究》伦理快速审查情况。项目负责人按照标准操作程序进行汇报、答辩,委员经过集体讨论、投票表决。
相关资料
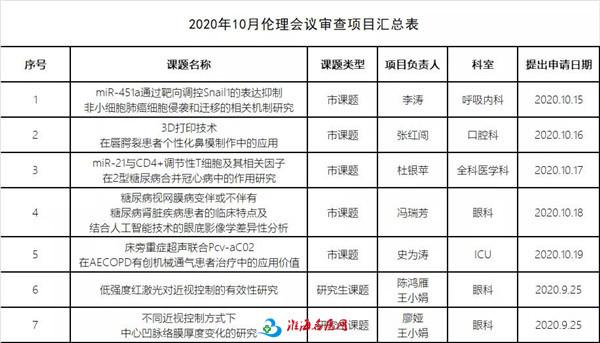
2020年10月伦理会议审查项目汇总表
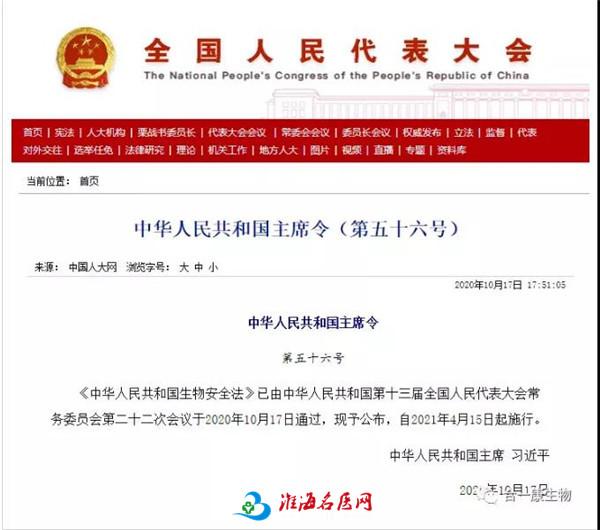
为加强医疗卫生机构临床研究和生物安全管理,规范临床研究行为,促进临床研究健康发展,2014年国家卫生健康委颁布了《医疗卫生机构开展临床研究项目管理办法》(国卫医发[2014]80号),2016年国家卫生健康委颁布了《涉及人的生物医学研究伦理审查办法》(11号令),2019年国家卫生健康委和中国医院协会联合颁布《涉及人的临床研究伦理审查委员会建设指南》(医协会发[2019]18号),2019年国务院颁布了《中华人民共和国人类遗传资源管理条例》(国令第717号),2020年4月23日国家药品监督管理局和国家卫生健康委联合颁布了《药物临床试验质量管理规范》(2020年第57号),2020年10月17日,国家主席习近平签署了《生物安全法》(主席令第五十六号)。
未设立医学伦理委员会的医疗卫生机构,不得开展涉及人的生物医学研究工作。伦理委员会对受理的申请项目应当及时开展伦理审查,提供审查意见;对已批准的研究项目进行定期跟踪审查;发生SAE应召开紧急会议审查。此外,还要受理受试者的投诉并协调处理,确保项目研究不会将受试者置于不合理的风险之中。各级卫生行政监督部门应当加强对辖区内医疗卫生机构开展临床研究项目的监督管理,发现医疗卫生机构违反规定、未履行监督管理职责的,应当责令其立即停止该研究,并按照相关法律法规给予行政处罚及处分。未经医疗卫生机构批准,卫生专业技术人员擅自开展临床研究、调整已批准研究方案或者私自收受申办方临床研究项目经费的,医疗卫生机构应当按照相关规定予以相应处理。

扫一扫,分享本页





