徐州市第一人民医院召开2021年2月伦理审查会
信息来自:徐州健康网 发布时间:2021-03-03 13:55:00 阅读量:10760次
[摘要]:淮海名医:根据伦理委员会制度和章程,我院伦理委员会2月26日对近期我院申请拟开展的18个涉及人的生物医学研究项目(科研课题、药物临床试验、修正案、科技论文)进行了伦理审查。主任委员赵玉良
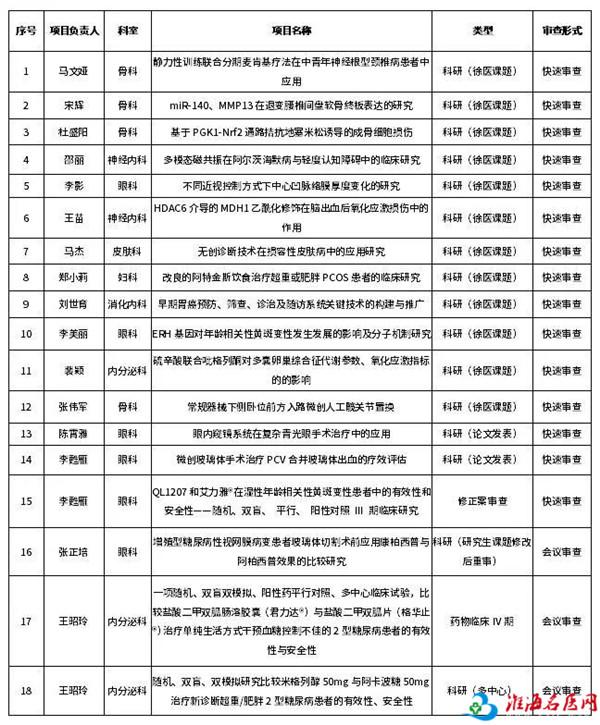
根据伦理委员会制度和章程,我院伦理委员会2月26日对近期我院申请拟开展的18个涉及人的生物医学研究项目(科研课题、药物临床试验、修正案、科技论文)进行了伦理审查。主任委员赵玉良,主审委员陈炳华、李泳等参加本次审查。



科普:医院伦理委员会
目前我国三级甲等医院和具有国家药物临床试验机构资质的二级、三级医院基本都设立了伦理委员会。伦理委员会在促进涉及人的生物医学研究中保护受试者的生命和健康权益、维护受试者的人身合法权益方面发挥了重要作用。2019年10月,国家卫健委和中国医院协会颁布了《涉及人的临床研究伦理审查委员会建设指南》,2020年4月,国家卫健委和国家药监局颁布了《药物临床试验质量管理规范》(2020版),这两个文件是我国伦理委员会建设和药物临床试验质量管理的纲领性文件。
伦理委员会的建设和伦理审查制度的完善,可以有效保证涉及人的生物医学研究科学性和伦理性的审查,成为整个受试者保护体系建设中的重要一环。伦理委员会对临床研究的科学性与伦理性进行审查,评价受试者参加该项临床研究的风险受益比,从而保护参加临床研究受试者的权益,成为受试者保护体系整体建设的重要环节。涉及人的生物医学研究科研项目的科学性审查和伦理性审查是不可分割的。知情同意原则、风险控制原则、隐私保护原则、免费和补偿原则、弱势群体保护原则、依法赔偿原则是伦理审查的“六大基本原则”。伦理审查是当今国际通行的控制研究风险的重要手段。
伦理委员会担负着平衡科学与伦理关系,评估风险与受益比的重要职责。随着各级别临床科研项目和药物/器械临床试验数量的不断增加,伦理审查工作遇到各个方面越来越多的问题。因此,提高伦理初始审查和持续跟踪审查监管各环节的审查质量,是临床科研伦理审查中面临的挑战。我院不断提炼科研/药物临床试验研究项目伦理审查的基本原则和关键要素,针对临床研究伦理初始审查和后期持续监管审查各环节的不同特点,采取不断完善伦理委员会制度和SOP,注重审查细节和过程控制,加强跟踪审查等措施,以全方位、多角度保护参加临床试验的受试者,应对伦理审查不断出现的新挑战,保证我院各项临床研究工作顺利开展。

扫一扫,分享本页





