市一院召开伦理审查会议

根据伦理委员会制度和标准操作规程(SOPV3.0版),医院医学伦理委员会10月8日对各临床医技科室9月份提交的10个涉及人的生命科学研究项目进行伦理审查。主任委员赵玉良,主审委员徐锋、靳雷,委员李泳,独立技术顾问,社区代表等参加本次审查。赵玉良主持会议。
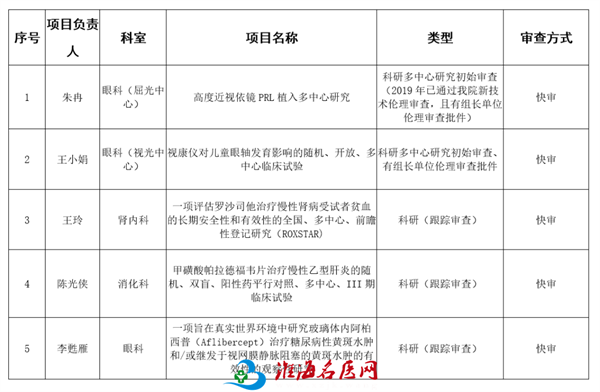

上午,在科教处办公区会议室对有组长单位伦理批件的科研多中心研究初始审查、已批准实施项目的跟踪审查、科技论文发表等7个项目进行快速伦理审查。两位委员仔细查看资料,对申请者进行提问,作出“同意”、“修改后重审”等意见。



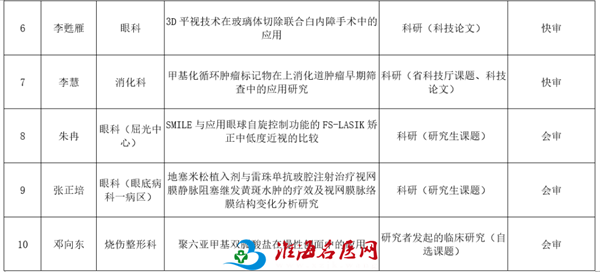
下午,在科研及教学培训中心—阶梯三教室召开伦理会议审查,主任委员赵玉良主持会议。伦理会议审查内容包括研究生课题、研究者发起的临床研究。项目负责人进行汇报答辩,通过集体评议、投票表决作出“修改后同意”、“修改后重审”等意见。

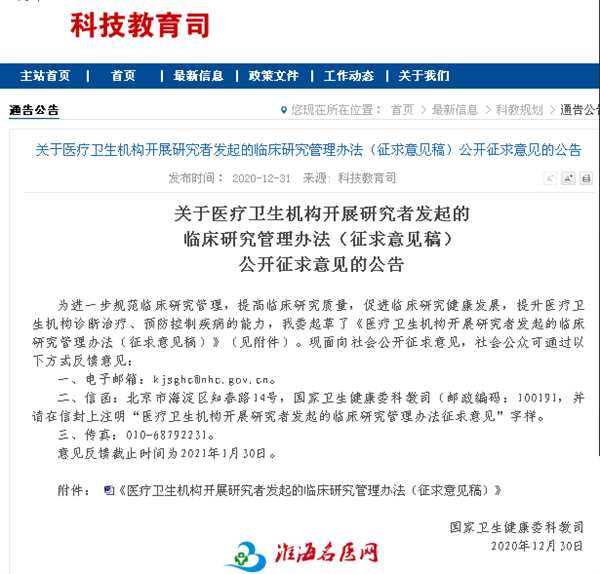
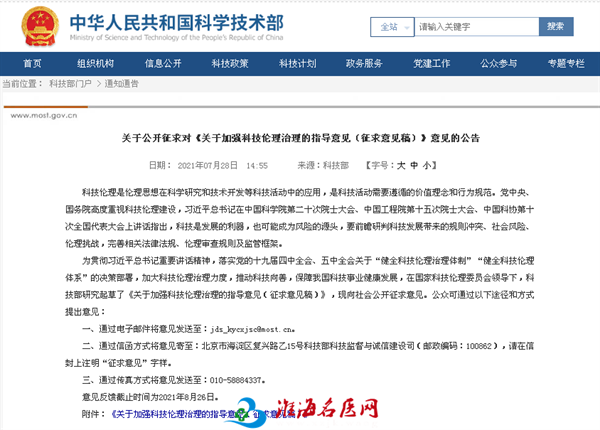
2014年,国家卫健委颁布了《医疗卫生机构开展临床研究项目管理办法》(国卫医发〔2014〕80号);2016年,国家卫健委颁布了《涉及人的生物医学研究伦理审查办法》(11号令)。2019年,国家卫健委和中国医院协会联合颁布了《涉及人的临床研究伦理审查委员会建设指南》(国协会发[2019]18号);2020年,国家药监局和国家卫健委联合颁布了《药物临床试验质量管理规范》(2020版);2021年,国家卫健委颁布了《涉及人的生命科学和医学研究伦理审查办法(征求意见稿)》和《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》(2021年10月1日在北京市、上海市、广东省和海南省先行试点实施)。2021年,科技部颁布了《关于加强科技伦理治理的指导意见(征求意见稿)》。
科技伦理是伦理思想在科学研究和技术开发等科技活动中的应用,是科技活动需要遵循的价值理念和行为规范,是科技事业健康发展的重要保障。医疗卫生机构开展临床研究,均应通过“科学性审查”和“伦理审查”。在研究过程中,要充分尊重研究对象的知情权和自主选择权。
党中央、国务院高度重视科技伦理建设,习近平总书记在中国科学院第二十次院士大会、中国工程院第十五次院士大会、中国科协第十次全国代表大会上讲话指出,科技是发展的利器,也可能成为风险的源头,要前瞻研判科技发展带来的规则冲突、社会风险、伦理挑战,完善相关法律法规、伦理审查规则及监管框架。
坚持促进创新与防范风险相统一、制度规范与自我约束相结合的治理原则,建立完善符合国情、国际接轨的科技伦理制度,塑造科技向善的文化理念,让科技更好造福人类,推动构建人类命运共同体。国家对临床研究的监管越来越重视,旨在以管理促进发展,保证依法合规开展临床研究。

扫一扫,分享本页





