市一院召开12月伦理审查会议


按照伦理委员会制度和标准操作规程,医院医学伦理委员针对各临床医技科室11至12月提交的伦理审查申请,于12月底组织了伦理审查工作。主任委员赵玉良,主审委员刘向群,委员李泳,独立技术顾问、律师、社区代表等参加本次审查。赵玉良主持会议。
一、快速审查
快速审查会于12月22日下午、12月29日上午分别在科教处会议室和重症医学科会议室召开,对申报中国微循环学会糖尿病基金项目,已立项国家自然科学基金课题、省自然科学基金课题、市卫健委青年医学科技创新课题、徐州医科大学附属医院发展基金项目、科技论文发表等20个项目进行快速伦理审查。
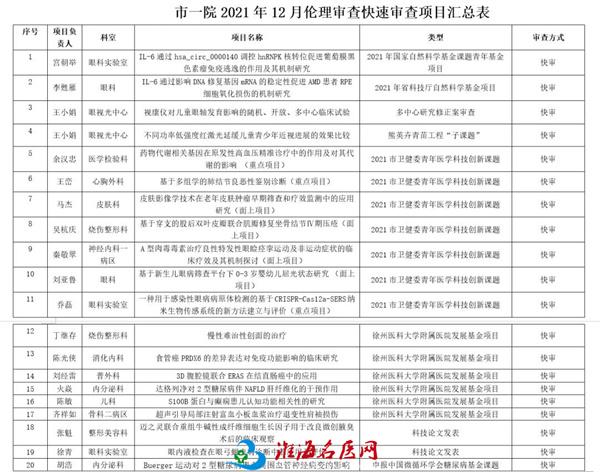
两位委员仔细查看资料,经过讨论、综合判断后作出“同意”、“不同意”等意见。
二、会议审查
12月29日下午,先后召开伦理委员会会议、伦理会议审查,赵玉良做2021年伦理委员会工作总结,制定2022年工作计划。随后,在伦理会议审查中,对III期药物临床试验、研究生课题、研究者发起的临床研究(医院为组长单位)等3个项目进行审查。项目负责人进行汇报答辩,通过集体评议、投票表决作出“同意”、“修改后同意”等意见。





相关链接
三级医院评审标准(2020年版)实施细则对伦理委员会的要求:
PART-1
医院应当设立伦理委员会,并采取有效措施保障伦理委员会独立开展伦理审查工作,所有涉及人的生物医学研究必须通过伦理委员会审查。伦理委员会应当建立伦理审查工作制度或者操作规程,人员组成、日常管理和审查工作应当符合《涉及人的生物医学研究伦理审查办法》规定,保证伦理审查过程独立、客观、公正。
PART-2
开展药物、医疗器械临床试验以及研究者发起的临床研究,应当充分考虑受试者权益保护,加强对相关试验产品以及干预手段的管理,保证研究方案科学、符合伦理,研究过程规范,结果真实、科学和可追溯。开展药物临床试验应当符合《药物临床试验质量管理规范》的相关规定;开展医疗器械临床试验应当符合《医疗器械临床试验质量管理规范》的相关规定;开展研究者发起的临床研究应符合《医疗卫生机构开展临床研究项目管理办法》的相关规定。

扫一扫,分享本页





